Arbeitsgruppen
Arbeitsgruppe "Aortic Lesions"
Erkrankungen der Aorta werden in einer alternden Bevölkerung zunehmend häufiger und sind von hoher gesamtgesellschaftlicher Relevanz. Aortenaneurysmen und –dissektionen sind schwerwiegende Erkrankungen, deren Entstehung und Therapie bislang nur unzureichend erforscht ist.
Die Arbeitsgruppe "Aortic Lesions" untersucht die Pathophysiologie dieser Erkrankungen. Ein besonderer Fokus liegt auf der Erforschung von Pathomechanismen etablierter Risikofaktoren, wie Alter, Bluthochdruck und Nikotinabusus. Neben grundlagenwissenschaftlichen Fragestellungen werden auch innovative Therapien und diagnostische Ansätze verfolgt. Ein Netzwerk von nationalen und internationalen Wissenschaftlern schafft ein stabiles Fundament, das es uns ermöglicht, gewonnene Erkenntnisse zu teilen und das Wissen über krankheitsspezifische Vorgänge zu vertiefen. Das übergeordnete Ziel unserer Arbeitsgruppe besteht in der Translation experimenteller Erkenntnisse in den klinischen Alltag.
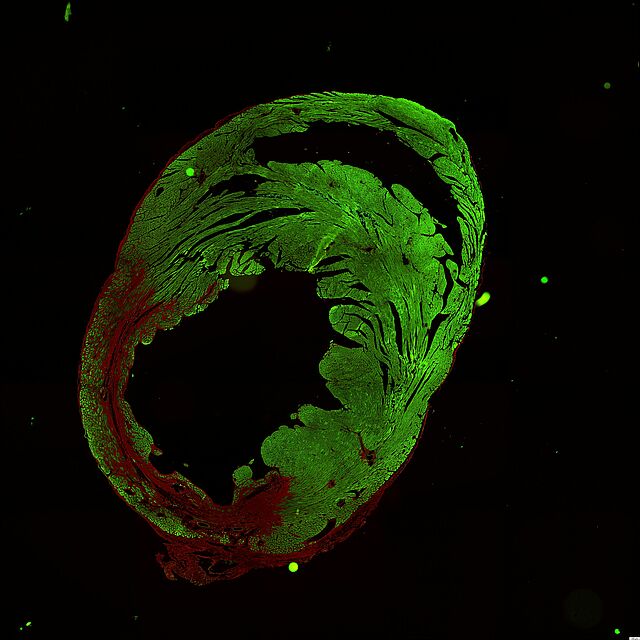
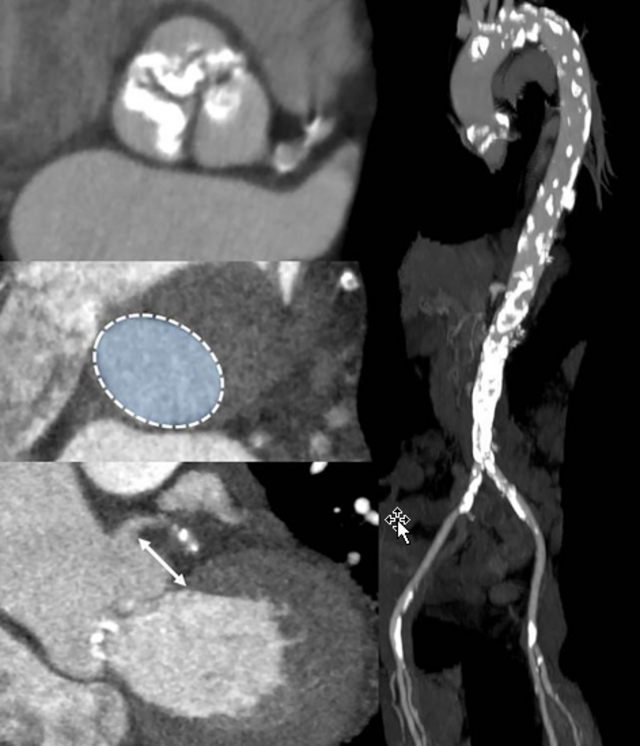
Das abdominelle Aortenaneurysma zeichnet sich durch eine progrediente Destruktion der Aortenwand aus. Die Fragmentierung von Elastin durch eine erhöhte Expression (obere Reihe rechts, rote Fluoreszenz) und Aktivität (untere Reihe rechts, grün-blaue Fluoreszenz) von Matrix-Metalloproteinasen (MMP) führt zu einer Zunahme der Aorten Steifigkeit und treibt die Zunahme des Aortendiameters. Dieser Prozess wird durch eine chronische Inflammation bedingt und durch Nikotin beschleunigt. Die meisten abdominellen Aortenaneurysmen bergen einen intraluminalen Thrombus, dem aus mechanischen und molekularbiologischen Aspekten besondere pathophysiologische Bedeutung zukommt.
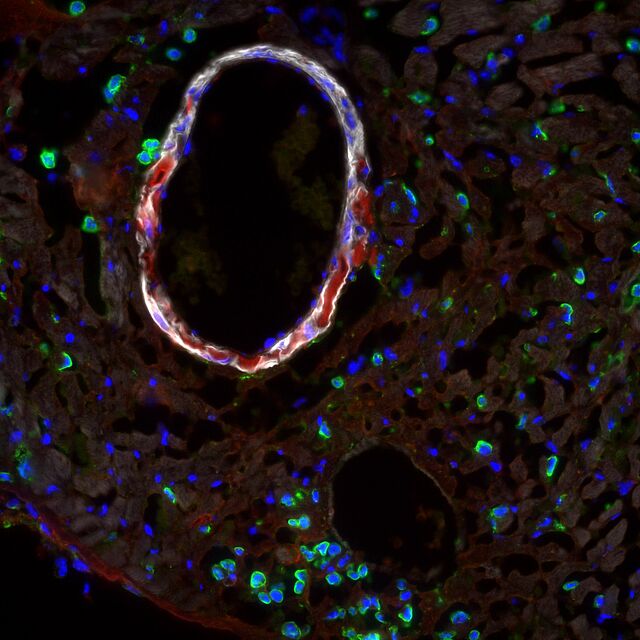
Die Aortendissektion entsteht durch einen Einriss der innersten endothelialen Zellschicht. Hier vermitteln "adherens junctions" (links, gelbe Fluoreszenz) die mechanische Stabilität, die durch Rauchen (Nikotin) und Bluthochdruck (Angiotensin II) supprimiert werden. Sukzessiv kommt es nach dem Einriss der Endothelzellschicht zu einer Lazeration der Aortenwand. Durch den Stabilitätsverlust besteht langfristig die Gefahr eines Dissektionsaneurysma mit potenzieller Rupturgefahr. Nicht-kodierende RNA Abschnitte sind potente intrazelluläre Regulatoren, die bedeutenden Einfluss auf die Proteinsynthese nehmen. Sie versprechen ein großes therapeutisches Potenzial und sind einer der wissenschaftlichen Schwerpunkte molekularbiologischen Aspekten besondere pathophysiologische Bedeutung zukommt.
Unsere AG arbeitet sowohl an klinischen Projekten, als auch auf dem Gebiet der Grundlagenforschung zu folgenden Themenschwerpunkten:
Schwerpunkt abdominelles Aortenaneurysma
- Exosomes as a novel therapeutic target in Aortic Aneurysm
Thema: Erforschung der Rolle von Exosomen und anderen cell-derived microvesicles auf den Progress des abdominellen Aortenaneurysmas - Effects of plasma therapy on Abdominal Aortic Aneurysm development
Thema: Erprobung von Plasmatherapie im experimentellen Modell für infrarenale Aortenaneurysmen
Schwerpunkt Akutes Aortensyndrom
- Disruption of the Endothelial Barier as a percusor for Aortic Dissection
Thema: Erforschung der Rolle von Zell-Zell- Kontakten und der Basalmembran in der Entstehung von Aortendissektionen - Aortic Arch Morphology and Geometry in acute aortic syndrom
Thema: Identifizierung von Aorten-morphologischen Risikokonfigurationen für das akute Aortensyndrom
Arbeitsgruppenleiter | Leitender Oberarzt, Facharzt für Gefäßchirurgie, Endovaskulärer Chirurg DGG
Den Lebenslauf von PD Dr. Markus Wagenhäuser können Sie hier auf der Seite des UKD abrufen.
PublikationsverzeichnisDas Publikationsverzeichnis von PD Dr. Markus Wagenhäuser können Sie hier über PubMed einsehen.
Arbeitsgruppe "Cardiovascular Immune Biology"
- Das Immunsystem in der kardiovaskulären Biologie
- Adaptive Immunität, T-Zellen und ihre Untergruppen bei Atherosklerose und Myokardinfarkt
- Die Funktion co-stimulatorischer Moleküle bei kardiovaskulären Erkrankungen und anderen entzündlichen Zuständen
- Thrombozyten als Teilnehmer an Immunmechanismen
- Die Rolle der T-Zellen bei Ischämie/Reperfusionsschäden
- Die Funktion co-stimulatorischer Moleküle (z. B. CD40/CD40L, CD27/CD70) bei akutem Myokardinfarkt
- Die zelltypspezifische Rolle von CD40/CD40L bei der Atherosklerose
- Die Schlaganfall-induzierte kardiovaskuläre Dysfunktion
- Reiche, M. E., den Toom, M., Willemsen, L., van Os, B., Gijbels, M., Gerdes, N., Aarts, S., & Lutgens, E. (2019). Deficiency of T cell CD40L has minor beneficial effects on obesity-induced metabolic dysfunction.BMJ open diabetes research & care, 7(1), e000829. doi.org/10.1136/bmjdrc-2019-000829
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6936585/
-
Bianchini M, Duchêne J, Santovito D, Schloss MJ, Evrard M, Winkels H, Aslani M, Mohanta SK, Horckmans M, Blanchet X, Lacy M, von Hundelshausen P, Atzler D, Habenicht A, Gerdes N, Pelisek J, Ng LG, Steffens S, Weber C, Megens RTA. PD-L1expression on nonclassical monocytes reveals their origin and immunoregulatory function. Sci Immunol. 2019;4(36):eaar3054. doi:10.1126/sciimmunol.aar3054
https://immunology.sciencemag.org/content/4/36/eaar3054
- Winkels H, Meiler S, Lievens D, Engel D, Spitz C, Burger C, Beckers L, Dandl A, Reim S, Ahmadsei M, Hartwig H, Holdt LM, Hristov M, Megens RT, Schmitt M, Biessen EA, Borst J, Faussner A, Weber C, Lutgens E, Gerdes N. CD27 co-stimulation increases the abundance of regulatory t cells and reduces atherosclerosis in hyperlipidemic mice. Eur Heart J. 2017, 38(48):3590-3599. (PMID: 29045618)
https://academic.oup.com/eurheartj/article/38/48/3590/4554905
- Winkels H, Meiler S, Smeets E, Lievens D, Engel D, Spitz C, Bürger C, Rinne P, Beckers L, Dandl A, Reim S, Ahmadsei M, Van den Bossche J, Holdt LM, Megens RT, Schmitt M, de Winther M, Biessen EA, Borst J, Faussner A, Weber C, Lutgens E, Gerdes N. CD70 limits atherosclerosis and promotes macrophage function. Thromb Haemost. 2017, 117(1):164-175. (PMID: 27786334)
https://www.thieme-connect.de/products/ejournals/abstract/10.1160/TH16-04-0318
- Gerdes N, Seijkens T, Lievens D, Kuijpers MJ, Winkels H, Projahn D, Hartwig H, Beckers L, Megens RT, Boon L, Noelle RJ, Soehnlein O, Heemskerk JW, Weber C, Lutgens E. PlateletCD40 Exacerbates Atherosclerosis by Transcellular Activation of Endothelial Cells and Leukocytes. Arterioscler Thromb Vasc Biol. 2016, 36(3):482-90. (PMID: 26821950)
https://www.ncbi.nlm.nih.gov/pubmed/26821950
- Wang J, Sun C, Gerdes N, Liu C, Liao M, Liu J, Shi MA, He A, Zhou Y, Sukhova GK, Chen H, Cheng M, Kuzuya M, Murohara T, Zhang J, Cheng X, Jiang M, Shull GE, Rogers S, Yang CL, Ke Q, Jelen S, Bindels R, Ellison DH, Jarolim P, Libby P, Shi GP. Interleukin 18 function in atherosclerosis requires both the interleukin 18 receptor and the Na-Cl co-transporter. Nat Med. 2015, 21(7):820-6. (PMID: 26099046)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4554539/
- Strodthoff D, Lundberg AM, Agardh HE, Ketelhuth DF, Paulsson-Berne G, Arner P, Hansson GK, Gerdes N. Lack of Invariant Natural Killer T Cells Affects Lipid Metabolism in Adipose Tissue of Diet-Induced Obese Mice. Arterioscler Thromb Vasc Biol. 2013, 33(6):1189-96. (PMID: 23520162)
https://www.ahajournals.org/doi/10.1161/ATVBAHA.112.301105
- Klingenberg R*, Gerdes N*, Badeau RM, Gisterå A, Strodthoff D, Ketelhuth DF, Lundberg AM, Rudling M, Nilsson SK, Olivecrona G, Zoller S, Lohmann C, Lüscher TF, Jauhiainen M, Sparwasser T, Hansson GK. Depletion of FOXP3+ regulatory T cells promotes hypercholesterolemia and atherosclerosis. J Clin Invest. 2013, 123(3):1323-34. (PMID: 23426179) (* indicates equal contribution)
https://www.jci.org/articles/view/63891
- Gerdes N, Zhu L, Ersoy M, Hermansson A, Hjemdahl P, Hu H, Hansson GK, Li N. Platelets regulate CD4⁺ T-cell differentiation via multiple chemokines in humans. Thromb Haemost. 2011, 106(2):353-62. (PMID: 21655676)
https://www.ncbi.nlm.nih.gov/pubmed/21655676
- Zirlik A, Maier C, Gerdes N, MacFarlane LA, Soosairajah J, Bavendiek U, Arens I, Ernst S, Bassler N, Missiou A, Patko Z, Aikawa M, Schönbeck U, Bode C, Libby P, Peter K. CD40L mediates inflammation independently of CD40 by interaction with Mac-1. Circulation. 2007, 115(12):1571-1580. (PMID: 17372166)
https://www.ncbi.nlm.nih.gov/pubmed/17372166
- Schönbeck U, Gerdes N, Varo N, Reynolds RS, Horton DB, Bavendiek U, Robbie LA, Ganz P, Kinlay S, Libby P. Oxidized low-density lipoprotein augments and 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors limit CD40 and CD40L expression in human vascular cells. Circulation 2002, 106(23):2888-2893. (PMID: 12460867)
https://www.ncbi.nlm.nih.gov/pubmed/12460867
- Gerdes N, Sukhova GK, Libby P, Young JL, Reynolds RS, Schönbeck U. Expression of interleukin (IL)-18 and functional IL-18 receptor on human vascular endothelial cells, smooth muscle cells, and macrophages: implications for atherogenesis. J Exp Med. 2002, 195(2):245-257. (PMID: 11805151)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2193607/
Arbeitsgruppenleiter | Direktor des Cardiovascular Research Laboratory
Mehr zu Prof. Dr. Norbert Gerdes auf der Seite des UKD
Arbeitsgruppe "Kardiovaskuläre Degeneration" | AG Haendeler und AG Altschmied
Arbeitsgruppenleiterin
Nach Ihrer DFG-Förderung durch eine Heisenberg Professur von 2014 bis 2019 wurde Frau Prof. Judith (Jojo) Haendeler verstetigt. Sie arbeitet seit vielen Jahren an Signalübertragungswegen, der Redox-Homöostase und mitochondrialen Funktionen in der kardiovaskulären Alterung und bei kardiovaskulären Erkrankungen. Ihre Arbeiten zu Thioredoxin-1 zeigten, dass dieses kleine Protein – neben seiner Enzymaktivität als Oxidoreduktase – viele weitere Funktionen hat, die durch Interaktionen mit einer Vielzahl von nukleären und cytosolischen Proteinen vermittelt werden. Zudem war Sie einer der ersten, die mitochondriale Funktionen von Telomerase Reverse Transkriptase beschrieben hat und demonstriert hat, dass diese eine essentielle Rolle im kardiovaskulären System in vivo hat, was von Ihr auch für mitochondriales CDKN1B/p27 gezeigt worden war. Zurzeit geht sie der Frage nach, wie man die mitochondrialen Level beider Proteine erhöhen kann, um damit das therapeutische Potential solcher Interventionen zu untersuchen. Frau Prof. Haendeler ist nicht nur sehr gut in die kardiovaskulären Forschungsaktivitäten am Standort Düsseldorf eingebettet, sondern auch durch eine Vielzahl nationaler und internationaler Kooperationen ausgewiesen.
Lebenslauf als PDF zum Download
Arbeitsgruppenleiter
Der Fokus von Herrn Prof. Joachim (Yogi) Altschmieds Arbeiten liegt auf den molekularen Mechanismen, die Herz- und Gefäßfunktionen regulieren; ein Schwerpunkt dabei ist die Transkriptionsregulation. In diesem Kontext konnte er zeigen, dass der Transkriptionsfaktor Grainyhead-like 3, der protektiv im Endothel ist, auch extra-nukleäre Funktionen hat. Zudem ist er Experte in Mausgenetik und hat mehrere neue, einzigartige Mausmodelle zur Untersuchung Organell-spezifischer Funktionen von Proteinen, die sowohl im Zellkern, als auch in Mitochondrien lokalisiert sind, generiert. Mit diesen Modellen identifiziert und charakterisiert er mitochondriale Interaktionspartner von Telomerase Reverse Transcriptase und CDKN1B/p27 in enger Zusammenarbeit mit Frau Prof. Haendeler und Partnern am Fritz Lipman Institute in Jena und anderen Institutionen in Deutschland und weltweit.
Lebenslauf als PDF zum Download
Laborleitung, Tierversuchsverantwortliche
Lebenslauf als PDF zum Download
Arbeitsgruppe "Molekulare Bildgebung"
In den letzten 10-15 Jahren hat sich immer stärker herauskristallisiert, dass entzündliche Prozesse eine große Bedeutung für die Entstehung und Progression von entzündlichen Erkankungen, wie der Atherosklerose, einem Myokardinfarkt, aber auch bei Krebs oder neurologischen Erkrankungen. Nichtinvasive molekulare Bildgebung könnte dabei helfen die pathophysiologischen Mechanismen besser aufklären und neuartige Behandlungsmöglichkeiten zu entwickeln.
Eine Technologie, welche die Visualisierung von Entzündungsprozessen ermöglicht basiert auf der kombinatorischen 1H/19F Magnetresonanztomographie (19F MRT). Besonderheiten der 19F MRT sind, dass die NMR Empfindlichkeit ähnlich des 1H Kerns ist, und 19F in biologischen Geweben kaum vorkommt. Somit kann die Detektion einer Anreicherung von 19F Atomen recht empfindlich und hochspezifisch mittels 19F MRT nachgewiesen werden. Für die Bildgebung von Entzündungsprozessen werden zumeist sog. Perfluokarbon Nanoemulsionen eingesetzt, die nach intravenöser Applikation von phagozytischen Immunzellen v.a. Monozyten und Makrophagen aufgenommen werden. Die Anreicherung dieser innerhalb entzündeter Bereiche kann dann eindeutig über 1H/19F MRT dargestellt werden1–4.
Um die Bandbreite der Strukturen und Zellen zu erhöhen, die mittels 19F MRT dargestellt werden können, haben wir eine Plattform zum aktiven Targeting der PFCs aufgebau5. Hierbei kombinieren wir spezifische Targeting-Liganden mit einer PEGylierung der Partikeloberfläche, wodurch wir in der Vergangenheit frühe venöse Thromben6, aktivierte Plättchen7, Progenitorzellen des Herzens8, oder kürzlich auch die Wanderungsbewegungen von Neutrophilen Granulozyten beobachten konnten9. Kürzlich war es uns zudem möglich thromboentzündliche Prozesse über die simultane Visualisierung von Monozyten/Makrophagen, Faktor XIIIa und Fibrin mit Hilfe von PFCs mit individuellen spektralen Signaturen darzustellen10.

Abbildung 1: Perfluorkarbon-Nanoemulsionen bieten eine Vielfalt an Möglichkeiten durch aktives Targeting Zellen und Strukturen entzündlicher und thromboentzündlicher Prozesse anzusteuern und diese dann mit Hilfe von Perfluokarbonen mit individuellen spektralen Signaturen über sog. Mehrfarben 19F MRT darzustellen. Das Multicolor 1H-/19F-Bild (oben links) zeigt die Anreicherung von inflammatorischen Zellen (rot = Monozyten/Makrophagen), sowie von thrombotischen Prozessen (cyan = FXIIIa-Aktivität, magenta = Fibrin). Diese Abbildung wurde aus Kleimann et al. 202311 entnommen und die Legende angepasst. (Teile dieser Abbildung wurden aus Flögel et al. (2021)10 übernommen. Ein Teil der schematischen Zeichnungen stammt von: smart.servier.com)
Aktuell arbeiten wir daran die PFCs weiter zu optimieren, um die Empfindlichkeit und Spezifität, sowie das Einsatzspektrum weiter zu verbessern. Zudem untersuchen wir wie sich die Stimulationen des Immunsystems durch unterschiedliche Trigger auf die Entwicklung, Progression und Heilung von entzündlichen Prozessen auswirkt.
Weitere Informationen über den technologischen Hintergrund und weitere experimentelle Anwendungsgebiete der Magnetresonanztomographie entnehmen sie bitte der Webseite der Arbeitsgruppe „Experimentelle kardiovaskuläre Bildgebung“.
- Flögel, U. et al. In vivo monitoring of inflammation after cardiac and cerebral ischemia by fluorine magnetic resonance imaging. Circulation 118, 140–148 (2008).
- Ebner, B. et al. Early Assessment of Pulmonary Inflammation by 19F MRI In Vivo. Circ. Cardiovasc. Imaging 3, 202–210 (2010).
- Flögel, U. et al. Selective activation of adenosine A2A receptors on immune cells by a CD73-dependent prodrug suppresses joint inflammation in experimental rheumatoid arthritis. Sci. Transl. Med. 4, 146ra108 (2012).
- Temme, S. et al. Beyond Vessel Diameters: Non-invasive Monitoring of Flow Patterns and Immune Cell Recruitment in Murine Abdominal Aortic Disorders by Multiparametric MRI. Front. Cardiovasc. Med. 8, 1421 (2021).
- Temme, S., Grapentin, C., Güden-Silber, T. & Flögel, U. Active Targeting of Perfluorocarbon Nanoemulsions. in Fluorine Magnetic Resonance Imaging 97–133 (CRC Press, 2016).
- Temme, S. et al. Noninvasive Imaging of Early Venous Thrombosis by 19F Magnetic Resonance Imaging With Targeted Perfluorocarbon Nanoemulsions. 131, (2015).
- Wang, X. et al. Fluorine-19 Magnetic Resonance Imaging of Activated Platelets. J. Am. Heart Assoc. 9, e016971 (2020).
- Straub, T. et al. MRI-based molecular imaging of epicardium-derived stromal cells (EpiSC) by peptide-mediated active targeting. Sci. Rep. 10, 21669 (2020).
- Bouvain, P. et al. Non-invasive mapping of systemic neutrophil dynamics upon cardiovascular injury. Nat. Cardiovasc. Res. (2023) doi:10.1038/s44161-022-00210-w.
- Flögel, U. et al. Multi-targeted 1H/19F MRI unmasks specific danger patterns for emerging cardiovascular disorders. Nat. Commun. 12, 5847 (2021).
- Kleimann, P. et al. Bildgebung von thromboentzündlichen Prozessen durch multispektrale 19F-MRT. Gefässchirurgie (2023) doi:10.1007/s00772-023-01045-w.